
关于“亚细胞定位”伯小远在前面已经推出了好几期的文章,但仍有童鞋觉得不够,不够咋办呢?那就继续安排咯~谁让伯小远是个宠粉狂魔呢!
亚细胞定位的重要性在前面的文章中已经讲过了,这里就不再多讲,我们只要记住,研究蛋白的亚细胞定位对于研究基因的功能、蛋白互作及其作用机理是非常有必要的就可以了。本期的文章不讲太多原理性的东西,主要为大家展示定位在不同的亚细胞结构的图片具体长什么样子,不要问伯小远为什么要大费精力去搜集这些东西,等你看完下面的内容就会明白,并且还会感谢伯小远哦!
1.研究亚细胞定位的一般方法
研究一个未知基因的蛋白亚细胞定位时,一般可以先用生物信息学的方法预测该基因的亚细胞定位(下表给出了一些预测亚细胞定位结果的网站(表1)),但绝大多数的预测程序算法是有一定局限的,其预测数据一般只能作为参考,具体的定位还得以实际的实验结果为准。
表1 蛋白质亚细胞定位的部分预测软件和网站(Donnes and Hoglund, 2004)。

目前植物蛋白质的亚细胞定位方法中应用较普遍的是借助于报告基因表达产物来实现目标蛋白定位的融合报告基因定位法,其中绿色荧光蛋白应用最为广泛。该方法一般需要借助一些已知定位的蛋白marker作为参照,从而判断出未知基因的定位情况。那么蛋白marker怎么选?在实际的操作过程中一般先单独对目的基因进行预实验,根据预实验的结果判断其可能的定位,然后再选择对应的蛋白marker进行共转,进一步验证其亚细胞定位。单看这句话似乎很简单,但如果你对于不同的亚细胞结构长啥样都不清楚,又如何根据预实验结果选择对应的蛋白marker呢?为了解决这个问题,伯小远先带你回顾一下基础的知识!
2.植物细胞结构
下面是一张植物细胞的亚显微结构图(图1),我们研究的目的基因可能定位在其中任何一个亚细胞结构上,因此先记清楚这些结构,然后和伯小远一起去文献里面看看定位在不同的亚细胞结构上的图片都长什么样吧!
 图1 植物细胞的亚显微结构。
图1 植物细胞的亚显微结构。
3.各亚细胞结构的定位情况
下面讲到的亚细胞定位,其用到的方法基本都是融合报告基因定位法,通过瞬转烟草叶片或原生质体在共聚焦显微镜下拍照观察到的结果。
3.1定位在细胞质
我们首先看一看定位在细胞质具体长什么样子,下面是一篇文献,该文献讲到,在35S启动子的驱动下,将AtHSBP融合到GFP的N端(AtHSBP-GFP),并在野生型拟南芥叶肉原生质体中进行分析,以评估热休克反应(HSR)期间的亚细胞定位情况(图2)。原生质体在不进行热休克(HS)处理(CK)的情况下,或在37℃时用HS处理1h(H1R0),然后从HS处理后恢复1h(H1R1)或2h(H1R2)以衰减热休克反应(HSR)。在正常情况下,AtHSBP-GFP主要在细胞质中(CK)中表达。而H1R0处理后,在细胞核内也可以观察到微弱的GFP信号。在H1R1恢复期间,AtHSBP-GFP转移到细胞核中,然而,在H1R2恢复期间,无法检测到核定位的GFP信号。这些数据表明AtHSBP在热胁迫下可由细胞质定位易位到细胞核中。

图2 AtHSBP在拟南芥叶肉原生质体中的瞬时表达(Hsu et al.,2010)。AtHSBP在叶肉原生质体中的瞬时表达。用AtHSBP-GFP转染野生型拟南芥原生质体,不经HS(CK)或在37℃时HS处理1h(H1R0),从HS处理后恢复1h(H1R1)或2h(H1R2)。用共聚焦显微镜观察GFP信号。蓝色表示4',6二脒基-2-苯吲哚盐酸(DAPI)染色的细胞核,红色表示叶绿体的自发荧光。
从这个例子我们可以看出,若一个基因定位在细胞质中,在一些情况下我们是可以看到布满整个原生质体的GFP信号的(如图2 CK,由于该目的基因并不定位在叶绿体中,因此存在一些被叶绿体遮挡的空缺);另外,由于植物细胞一般都存在大液泡,液泡的存在往往会将细胞质挤压到紧挨细胞膜的位置,这个时候我们并不能看到布满整个原生质体的GFP信号,就比如下面这个例子(图3),35S驱动GFP在烟草原生质体中的瞬时表达,理论上应该是任何亚细胞器中都存在GFP信号,但是图3i中却存在很大一个空缺没有荧光信号,这个空缺的部分可能就是液泡,这个时候细胞质中的荧光信号就是紧挨细胞膜的,如果遇到这种情况,就需要通过marker来区分出到底是定位在细胞质还是定位在细胞膜中,又或者是细胞膜和细胞质中都有信号。
 图3 35S-GFP在烟草原生质体中的表达(Liu et al., 2020)。
图3 35S-GFP在烟草原生质体中的表达(Liu et al., 2020)。
3.2定位在液泡
在一篇文献中,作者为了验证GmVTL1a的亚细胞定位,将GFP融合在基因的ORF的N端,并通过瞬时转化烟草原生质体进行观察,有趣的是,GFP蛋白的荧光信号仅在携带GFP-GmVTL1a转基因的烟草原生质体的液泡膜上观察到(图4a-h),这很容易与叶绿体(ChlorophyII)、细胞膜标记物FM4-64FX的信号区分开来。

图4 GmVTL1a在烟草原生质体中的亚细胞定位(Liu et al., 2020)。(a,e)绿色表示GFP信号。(b)粉色表示叶绿体自身荧光。(f)红色表示细胞膜标记物FM4-64FX。(c,g)灰色显示明场。(d,h)合并后的图像显示了合并后的三个通道。
注:这里作者证明目的基因定位在液泡膜上并不是直接证明的,而是通过和细胞膜标记物FM4-64FX不重合间接证明的,大家在以后的学习中要是遇到不能直接证明的,也可以学习这种间接证明的方法哦!
3.3定位在叶绿体
上面的例子用到的方法都是瞬时转化原生质体对目的基因的亚细胞定位进行观察,并且都给出了叶绿体自发荧光的照片,想必大家都已经知道在原生质体中叶绿体长什么样子了,那么在烟草叶片中叶绿体会是什么样子呢?请跟伯小远一起看看下面的例子吧。从图5中可以看到用于检测PnToxA叶绿体定位的序列ToxA62-132融合GFP之后其亚细胞定位与叶绿体标记RUB1sp-mCherry的荧光在叠加图中完全重合,因此说明ToxA62-132-GFP定位在叶绿体中。

图5 用于检测PnToxA叶绿体定位的序列的亚细胞定位(Sperschneider et al., 2017)。共聚焦图像显示了ToxA62-132-GFP在本氏烟细胞中的叶绿体定位。左图显示叠加了ToxA62-132-GFP和RUB1sp-mCherry荧光的透射光图像。中间的图显示RUB1sp-mCherry荧光(叶绿体标记物),而右边的图显示ToxA62-132-GFP荧光。
如果我们观察到的荧光呈点状,并且与叶绿体的marker重合,那么我们可以考虑一下其亚细胞定位是否定位在内囊体或者质体上(图6)。

图6 表达PGTG_00164-YFP(a)或PGTG_06076-YFP(b)的细胞显示叶绿体点状定位,提示其定位可能是类囊体或质体(Sperschneider et al., 2017)。
3.4定位在内质网
内质网,光听这个名字就知道其形状应该和“网”脱不了关系,通过实验证实定位在内质网中的形状确实也都是网状的,下面给出了两个在烟草叶片细胞中定位在内质网中的图片(图7,图8)。

图7 拟南芥细胞分裂素受体AHK3定位于瞬时转化的烟草叶片细胞和拟南芥幼苗的内质网(Caesar et al., 2011)。(A-D)35S启动子或UBQ10启动子驱动AHK3与内质网标记ER-rk CD3-959的烟草叶表皮细胞中共表达的共聚焦图像。
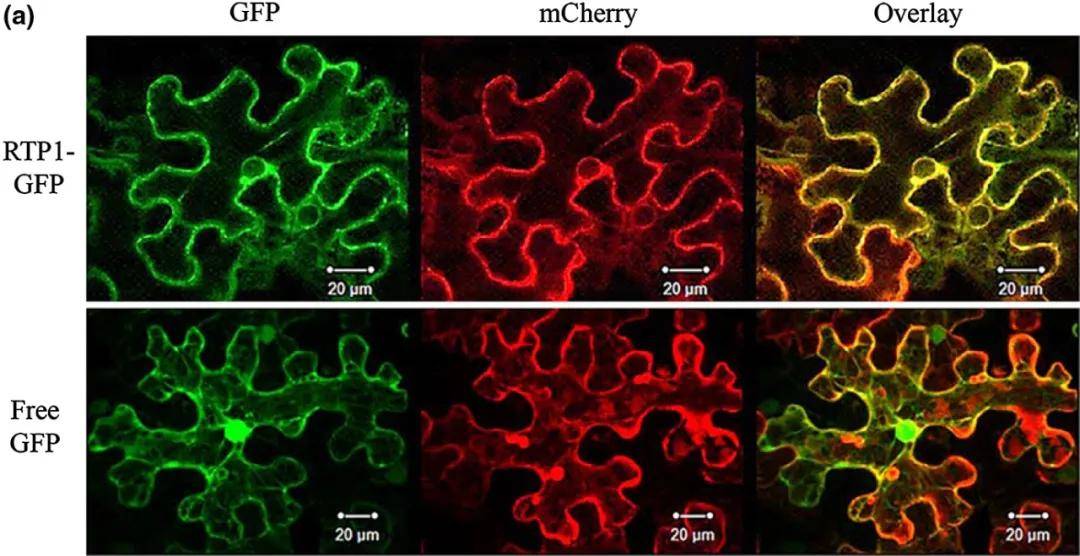
图8 RTP1-GFP的亚细胞定位。RTP1-GFP或Free-GFP在烟草叶片中瞬时表达,并在共聚焦显微镜下观察荧光。RTP1:GFP融合蛋白定位于烟草表皮细胞的内质网(ER)。Free GFP作为对照。ER标记为红色荧光,GFP荧光为绿色。Overlay是绿色荧光和红色荧光的叠加图。
3.5定位在细胞核
我们都知道转录因子一般定位在细胞核中,下面这个例子就是参与拟南芥防御信号通路的关键转录因子AtWRKY29,在一种南极开花植物南极漆姑草原生质体中的亚细胞定位情况,可以看出其亚细胞定位仅定位于细胞核中(图9b)。

图9 AtWRKY29在南极漆姑草原生质体中的亚细胞定位(Cha et al., 2019)。(a)35-GFP;(b)AtWRKY29-GFP。
3.6定位在核膜
定位在核膜,植物中我们一般比较少见,而人类的许多罕见疾病,如肌肉萎缩、视神经萎缩和早衰症,都与核膜成分的突变密切相关,植物在核膜这一方面研究的比较少,今天我们就只看看定位在核膜上的亚细胞定位图片。下面的基因PNET7就是定位在核膜上的一个例子(图10)。

图10 YFP标记的PNET7在烟草叶片中瞬时表达的亚细胞定位结果(Tang et al., 2020)。红色荧光代表细胞核。
3.7定位在核仁
很多时候我们都只关注一个基因是否定位于细胞核,没想到下面这个例子还专门把核仁单独拿出来研究了,其中PGTG_13278-YFP虽然定位于细胞核,但并不定位于细胞核中的核仁,而PGTG_15899-YFP不仅定位于细胞核也定位于核仁中,至于为什么,大家如果感兴趣,可以去看一下这篇文献喔!

图11 表达PGTG_13278-YFP的细胞表现为细胞核定位但排除核仁(a),表达PGTG_15899-YFP的细胞表现为细胞核和核仁定位(b)(Sperschneider et al., 2017)。
3.8多种亚细胞结构定位集锦
剩下的细胞器有一篇文献做的很全面,作者将一些细胞器的marker分别在水稻原生质体以及稳转水稻的叶片和根中进行了观察,因此这里就不再像上面一样详细地介绍了,大家可以看看下面两张图,一些还没来得及介绍的细胞器基本都在里面,其中也包括一些上面已经介绍过的,但不妨碍大家再看一遍,因为有时候用到的转化受体不一样,其形态可能也存在差异,好了,我们一起去看看吧!

图12 绿色荧光蛋白(GFP)和GFP融合细胞器标记物在水稻原生质体中的亚细胞定位(Wu et al., 2015)。(A)GFP在细胞质中的表达。(B)内质网(ER)标记SPAmy8-GFP-KDEL。(C)线粒体标记NRPS10-GFP。(D)质粒CD3-963包含高尔基体标记。(E)质粒CD3-971包含液泡标记。(F)细胞核标记OsRH36-GFP。(G)过氧化物酶体标记GFP-KSRM和(H)质膜标记OsRPK1-GFP。

图13 在转基因水稻植株中,针对不同细胞器的GFP或GFP融合细胞器标记物的亚细胞定位(Wu et al., 2015)。利用共聚焦显微镜在转基因水稻幼苗的叶片(左图)和根(右图)组织中显示GFP荧光。(A)GFP在细胞质中的表达。(B)内质网(ER)标记SPAmy8-GFP-KDEL。(C)线粒体标记NRPS10-GFP。(D)质粒CD3-963包含高尔基体标记。(E)质粒CD3-971包含液泡标记。(F)细胞核标记OsRH36-GFP。(G)过氧化物酶体标记GFP-KSRM和(H)质膜标记OsRPK1-GFP。
3.9一些特殊的亚细胞结构定位
3.9.1定位在细胞骨架
细胞骨架一般是指细胞质中由蛋白质构成的纤维网格结构。它是一个动态结构,其中有一部分不断的被破坏,更新或新建,有些细胞可以通过骨架的破坏和重塑运动。下面给出了两个定位在细胞骨架中的例子,不仔细看很容易与内质网的定位混淆,正好伯小远找到了一个例子,同时给出了这两种亚细胞结构的定位情况,帮助你区分,真是贴心如我,哈哈!另外在其中一个例子中还给出了一些其它的细胞结构,买一送二,很赚有木有!
下面给出的这个例子不仅给出了细胞骨架的定位,还给出了肌动蛋白丝和微管的定位。大家可以自己对照区分一下哦!

图14 AtOFP1与细胞骨架有关(Hackbusch et al.,2005)。利用激光共聚焦显微镜对瞬时表达的GFP融合蛋白在本氏烟叶片中的定位进行了分析。(a)AtOFP1-GFP积聚在核仁中,且定位于细胞骨架。(b)肌动蛋白解聚药物cytochalasin D处理20分钟后,AtOFP1-GFP的定位没有改变。(c)Talin的I/LWEQ结构域融合GFP定位于肌动蛋白丝。(d)MAP3-GFP与微管相关。
下面这个例子中的a(图15a)定位于内质网,b(图15b)则定位于细胞骨架,两张图片都很清晰漂亮。根据图注大家可以发现这两个其实都是一个东西,大家有兴趣可以去研究一下这篇文献,这篇文献主要是关于亚细胞定位、非靶向运输以及胞间连丝之间的一些研究,这里就不详细解释了。
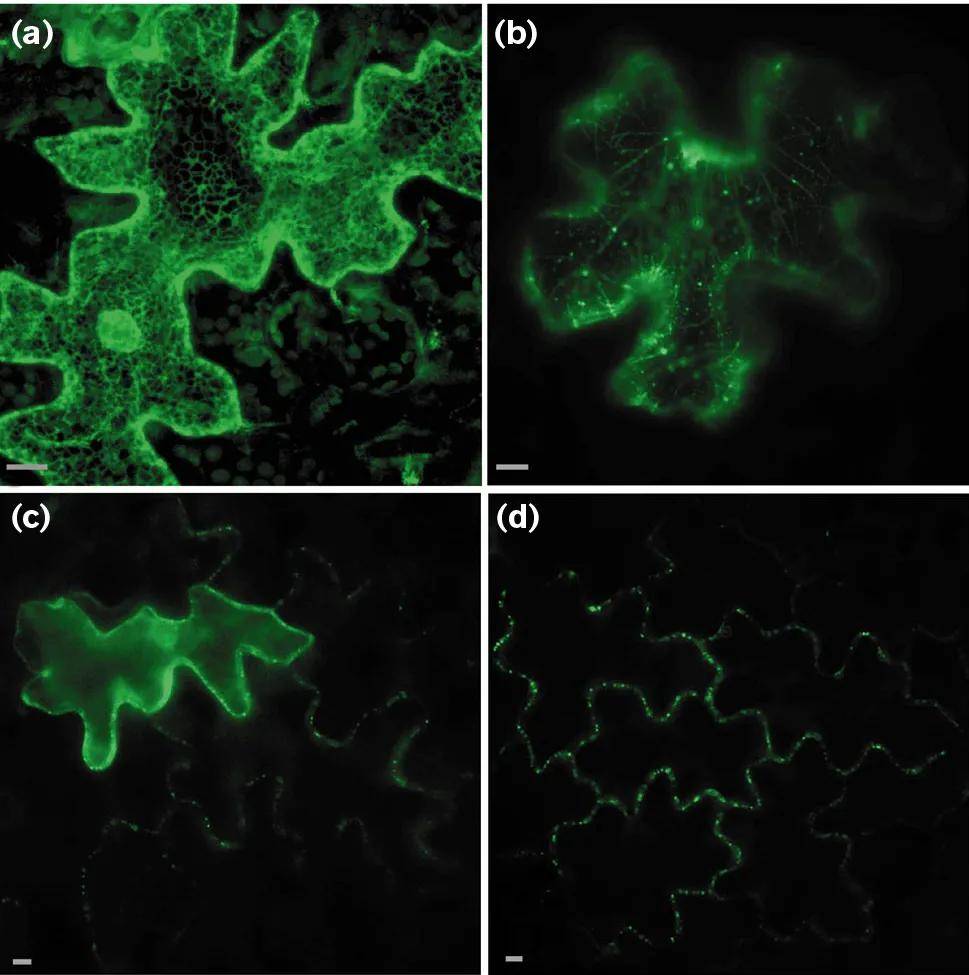
图15 TMV P30-rsGFP的靶向运输(Crawford et al., 2000)。P30-rsGFP定位于整个细胞和细胞壁的离散亚细胞位点。(a)共聚焦显微镜图像显示P30-rsGFP定位于内质网ER,(b)P30-rsGFP在细胞骨架中的定位,(c)P30-rsGFP定位于转染细胞的细胞质,并位于移动的细胞的细胞壁上(斑点状)。(d)P30-rsGFP细胞聚焦,该蛋白主要定位于胞间连丝的细胞壁点状处。
3.9.2 定位于肌动蛋白丝
其实在上面的“买一送二”中已经看过肌动蛋白丝的定位了,这里伯小远还想给大家一个高清放大的图看一看(图16c),加深大家的印象!

图16 亚细胞定位决定了蛋白在胞间连丝运输中的可用性(Crawford et al., 2000)。(a)ER-GFP定位于内质网腔,不能通过胞间连丝。(b)GFP-mTn定位于肌动蛋白丝,是细胞自主的。(c)转染GFP-mTn的细胞的高倍放大图,图中显示肌动蛋白丝。(d)NLS-rsGFP定位于细胞核,但也会转移到邻近细胞。转染后的细胞在细胞核、细胞膜和内质网ER中均含有NLS-rsGFP,而在邻近细胞中仅在细胞核中检测到NLS-rsGFP。(e)NLS-rsGFP从转染细胞转入邻近的12个细胞。(f)NLS-2×rsGFP在转染细胞中保留。
3.10核糖体和细胞壁定位的问题
最后给大家解释一下为什么没有给出定位在核糖体和细胞壁的图片,原因是这两个亚细胞结构伯小远没有找到比较好的相关文献,大家对这方面如果比较了解可以与伯小远互动哦!对于核糖体伯小远找到很多核糖体蛋白相关的基因,作者研究的都是核糖体之外的功能,其定位有的在细胞核,有的在细胞质,伯小远猜想可能是核糖体的功能(合成蛋白质)已经很清楚了,所以大家研究的都是核糖体之外的功能;而对于细胞壁,一般是通过烟草叶片或者洋葱表皮瞬时表达目的基因,通过质壁分离的方法来区分到底是定位在细胞膜还是细胞壁上。在这里伯小远分别找了通过洋葱表皮细胞和烟草叶片瞬时表达目的基因的例子,比较庆幸的是烟草叶片那个例子质壁分离之后在细胞壁上也有荧光,只不过是呈点状分布的,但是不管咋样伯小远还是找到了,只是没有找到那种完整定位于细胞壁上的例子!
在一篇文献中,作者首先证明了GTPases定位在细胞膜中,为了进一步验证GTPases的细胞膜定位,作者在高浓度NaCl溶液处理下诱导表达GFP CA-OsRac3和GFP CA-OsRac6的洋葱表皮细胞进行质壁分离。结果显示,在细胞质和细胞核中都发现了对照GFP(图17,左)。同样,GFP CA-OsRac6在细胞质、细胞核以及质壁分离后的细胞膜中均可见(图17,中间)。相反,GFP CA-OsRac3只在细胞膜中检测到,并且在质壁分离后随细胞膜收缩(图17,右)。

图17 0.5M NaCl溶液诱导洋葱表皮细胞中瞬时表达的GFP-OsRac3(右)和GFP-OsRac6(中间)的质壁分离分析(Chen et al., 2010)。35S-GFP(左)作为对照。
这个例子作者利用农杆菌介导的瞬时检测方法确定RBSDV P7-1的亚细胞定位。在CaMV 35S启动子的控制下,P7-1融合到增强绿色荧光蛋白(eGFP)的N端,在本氏烟草细胞中瞬时表达。注射后2天用共聚焦显微镜观察荧光。在表达P7-1:eGFP的表皮细胞中(图18A),细胞核、细胞质及细胞外周均有可见荧光,质浆裂解后的细胞沿细胞壁可见点状荧光。这种分布模式在表达对照35S:eGFP的细胞中没有发现,其中质膜荧光在质浆分解后从非荧光细胞壁分离出来。为了证实这一定位模式,作者将P7-1与黄色荧光蛋白的N端融合,在烟草的表皮细胞中表达。如图18B所示,P7-1:YFP在细胞核、细胞质和细胞外周均可见荧光,并在质壁分离后的叶片细胞沿细胞壁形成点状分布,而在表达35S:YFP的表皮细胞细胞壁未见荧光。这些结果表明P7-1与细胞壁有关。

图18 P7-1在本氏烟叶片细胞中的亚细胞定位。(A)35:eGFP(左)和P7-1:eGFP(右)在未质壁分离(上图)或质壁分离(下图)的本氏烟叶片细胞中的定位。放大区域显示P7- 1:eGFP的点状结构。(B)35:YFP(左)和P7-1:YFP(右)在未质壁分离(上)或质壁分离(下)烟草叶片细胞中的定位。放大的区域显示了P7-1:YFP的点状结构。白色和黑色箭头分别指向质壁分离后的细胞壁和质膜。
小远叨叨
看了以上不同基因定位在不同亚细胞器的荧光图片之后,想必大家对这些结构都有了一个大致的印象,有印象可不行,最好记住它们,这样当自己在研究一个新基因时,单独对新基因做完亚细胞定位的预实验之后,我们一定要尽可能准确地判断它的定位,然后选择合适的marker与其进行共定位,进而得到我们所要研究基因的亚细胞定位结果。再回到文章开头,大家是不是应该感谢一下伯小远呢!哈哈!最后,希望大家收藏本篇文章,没事拿出来多看一看,将这些不同的形状深深地刻在自己的脑海里,等到需要用的时候直接从大脑里面调取出来就可以啦!
References:
Caesar K, Thamm A M K, Witthöft J, et al. Evidence for the localization of the Arabidopsis cytokinin receptors AHK3 and AHK4 in the endoplasmic reticulum[J]. Journal of Experimental Botany, 2011, 62(15): 5571-5580.
Cha O K, Lee J, Lee H S, et al. Optimized protoplast isolation and establishment of transient gene expression system for the Antarctic flowering plant Colobanthus quitensis (Kunth) Bartl[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2019, 138(3): 603-607.
Chen L, Shiotani K, Togashi T, et al. Analysis of the Rac/Rop small GTPase family in rice: expression, subcellular localization and role in disease resistance[J]. Plant and cell physiology, 2010, 51(4): 585-595.
Crawford K M, Zambryski P C. Subcellular localization determines the availability of non-targeted proteins to plasmodesmatal transport[J]. Current Biology, 2000, 10(17): 1032-1040.
Dönnes P, Höglund A. Predicting protein subcellular localization: past, present, and future[J]. Genomics, proteomics & bioinformatics, 2004, 2(4): 209-215.
Hackbusch J, Richter K, Müller J, et al. A central role of Arabidopsis thaliana ovate family proteins in networking and subcellular localization of 3-aa loop extension homeodomain proteins[J]. Proceedings of the National Academy of Sciences, 2005, 102(13): 4908-4912.
Hsu S F, Lai H C, Jinn T L. Cytosol-localized heat shock factor-binding protein, AtHSBP, functions as a negative regulator of heat shock response by translocation to the nucleus and is required for seed development in Arabidopsis[J]. Plant physiology, 2010, 153(2): 773-784.
Liu S, Liao L L, Nie M M, et al. A VIT‐like transporter facilitates iron transport into nodule symbiosomes for nitrogen fixation in soybean[J]. New Phytologist, 2020, 226(5): 1413-1428.
Pan Q, Cui B, Deng F, et al. RTP 1 encodes a novel endoplasmic reticulum (ER)‐localized protein in Arabidopsis and negatively regulates resistance against biotrophic pathogens[J]. New Phytologist, 2016, 209(4): 1641-1654.
Sperschneider J, Catanzariti A M, DeBoer K, et al. LOCALIZER: subcellular localization prediction of both plant and effector proteins in the plant cell[J]. Scientific reports, 2017, 7(1): 1-14.
Sun Z, Zhang S, Xie L, et al. The secretory pathway and the actomyosin motility system are required for plasmodesmatal localization of the P7-1 of rice black-streaked dwarf virus[J]. Archives of virology, 2013, 158(5): 1055-1064.
Tang Y, Huang A, Gu Y. Global profiling of plant nuclear membrane proteome in Arabidopsis[J]. Nature Plants, 2020, 6(7): 838-847.
Wu T M, Lin K C, Liau W S, et al. A set of GFP-based organelle marker lines combined with DsRed-based gateway vectors for subcellular localization study in rice (Oryza sativa L.)[J]. Plant molecular biology, 2016, 90(1-2): 107-115.
好文推荐
【小远答疑】亚细胞定位常见问题
亚细胞定位的爱恨情仇:核、质之争
【干货】如何做蛋白亚细胞定位实验?
新上线“伯小远答疑”栏目,求围观!
来一场蛋白与蛋白间的“风花雪月”
最强大脑炼成记——如何验证一个基因是转录因子
茫茫“质”海,何以为家?——一种蛋白在不同亚细胞器定位的原因
伯远生物可提供以下技术服务
载体构建
亚细胞定位返回搜狐,查看更多

